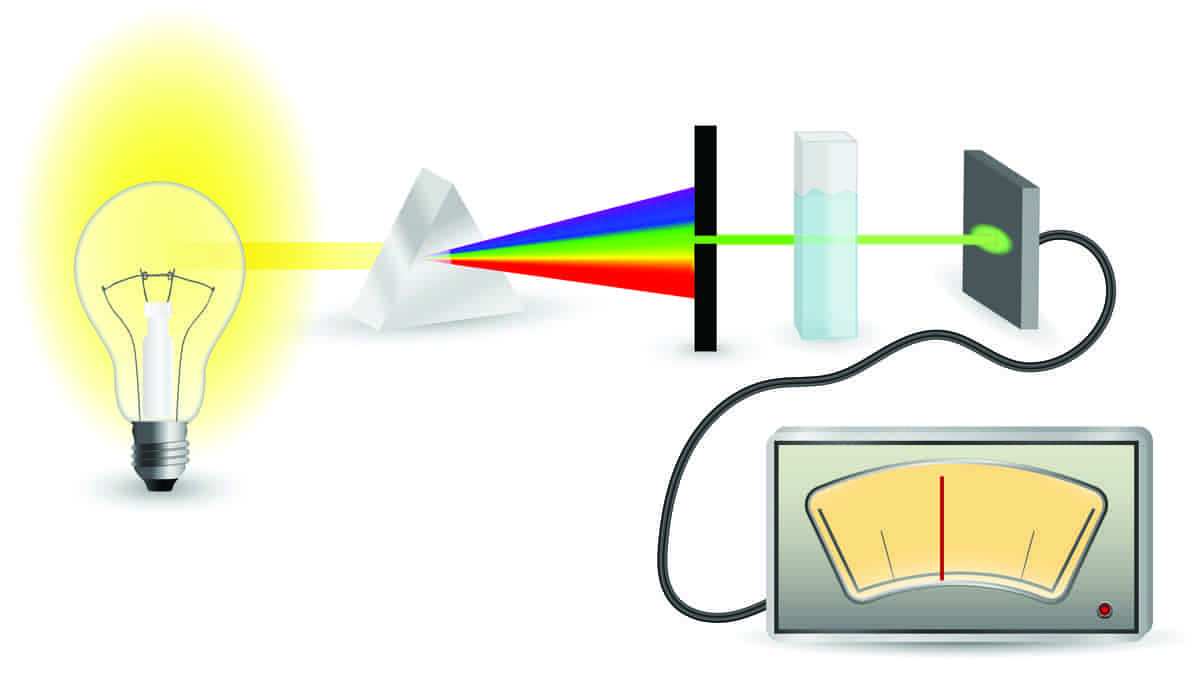
Beers lov benyttes for kvantitative bestemmelser (mengdebestemmelser) av kjemiske forbindelser, både molekyler, salter og grunnstoffer. Den sier at absorbansen (grad av lysabsorpsjon) er proporsjonal med konsentrasjonen av et stoff som kan absorbere elektromagnetisk stråling. Altså vil man kunne finne mengden av et stoff om man kan måle lysabsorpsjonen og vet fra før hvor mye stoffet absorberer, eller at man kan sammenligne med en standardprøve av stoffet.
For kjemiske forbindelser i en løsning (som holdes i lysstrålen i en transparent kyvette, et spesielt prøveglass uten egen lysabsorpsjon) skrives Beers lov på formen
A = log (P0/P) = ε · b · C
Her er A absorbansen (graden av lysabsorpsjon), P0 er intensiteten av parallell monokromatisk stråling som treffer kyvetten (altså lysmengden som treffer prøven i prøveglasset), P er intensiteten av strålingen som passerer gjennom kyvetten (transmittert stråling, altså lysmengden som går gjennom prøven), ε er molar absorptivitet (absorpsjonskoeffisienten, tidligere kalt ekstinksjonskoeffisienten, en konstant som er karakteristisk for lysabsorpsjonen til stoffet som skal måles), b er bredden av kyvetten (prøveglasset) og C er den molare konsentrasjonen av forbindelsen (altså hvor sterk prøven er).




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.