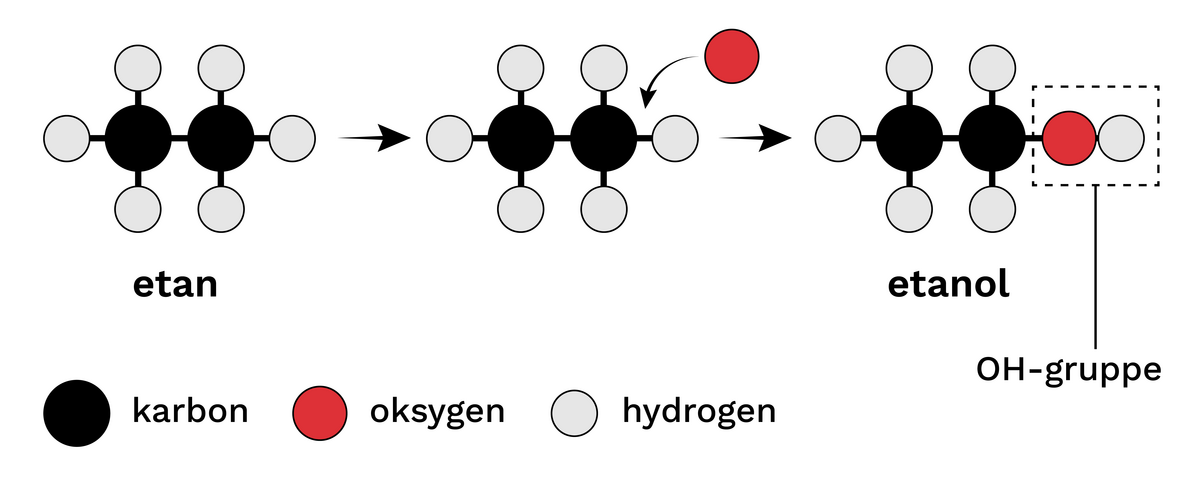
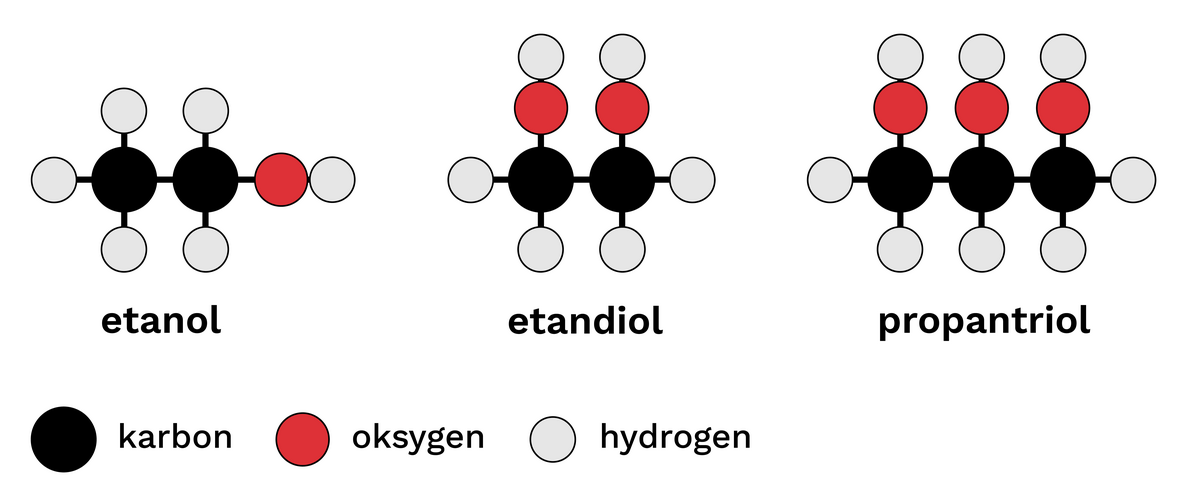
Alkoholar er ei stor og variert gruppe av organiske sambindingar som kan ha svært ulike eigenskapar. Felles for alle sambindingane er at dei har ei hydroksylgruppe, også kalla ei OH-gruppe.
Faktaboks
- Uttale
- alkoh'oler
Den enklast samansette av alle alkoholar er metanol, også kalla tresprit. Den nest enklaste alkoholen er etanol, som er eit av dei vanlegaste rusmidla. Når ein i daglegtalen snakkar om «alkohol», er det som regel etanol ein meiner. Andre kjende alkoholar er propanol, som blir brukte som lause- og desinfeksjonsmiddel, og isopropanol, som til dømes finst i vindaugsspylevæske.
- Les meir om alkohol – rusmiddel.
Mange alkoholar finst i naturen, ofte som estarar (til dømes glyserol i feittstoff). Enkelte blir danna naturleg ved gjæringsprosessar, medan andre berre blir framstilte syntetisk.
Alkoholar har mykje å seie som råstoff i kjemisk industri, som løysemiddel i teknikken, som råstoff i nærings- og nytingsmiddelindustrien og som del av levande organismar.







Kommentarar (2)
skreiv Anne Kristine F. Eide
Hei!
Det finnes alkoholer i de fleste kremer og salver, selv babysalver. Hvordan finner man ut hvilke alkoholer som i det hele tatt har mulighet til å påvirke sentralnervesystemet og hvilke mengder som i så fall må til?
svarte Einar Uggerud
Hei, Anne Kristine!
Beklager sent svar. Spørsmålet ditt er rimelig, men det er liten grunn til bekymring. Svært lite alkohol evner å trenge gjennom laget av hudceller. Dessuten vil mesteparten av alkoholen da allerede ha fordampet på grunn av kroppsvarmen. Skader på sentralnervesystemet skjer først og fremst hos langtkommede alkoholikere, og forekommer i nevneverdig grad hos dem med moderat alkoholforbruk. I disse tilfellene tas som kjent alkoholen opp gjennom tarmen, som i motsetning til huden, er spesialbygget nettopp for opptak til kroppen.
Jeg håper dette svaret er nyttig for deg.
Vennlig hilsen Einar Uggerud
Kommentarar til artikkelen blir synleg for alle. Ikkje skriv inn sensitive opplysningar, for eksempel helseopplysningar. Fagansvarleg eller redaktør svarar når dei kan. Det kan ta tid før du får svar.
Du må være logga inn for å kommentere.