Isomerer er kjemiske forbindelser som har samme molekylformel, men som har ulike kjemiske egenskaper. Det skyldes at atomene i molekylet er satt sammen på ulik måte i de ulike isomerene.
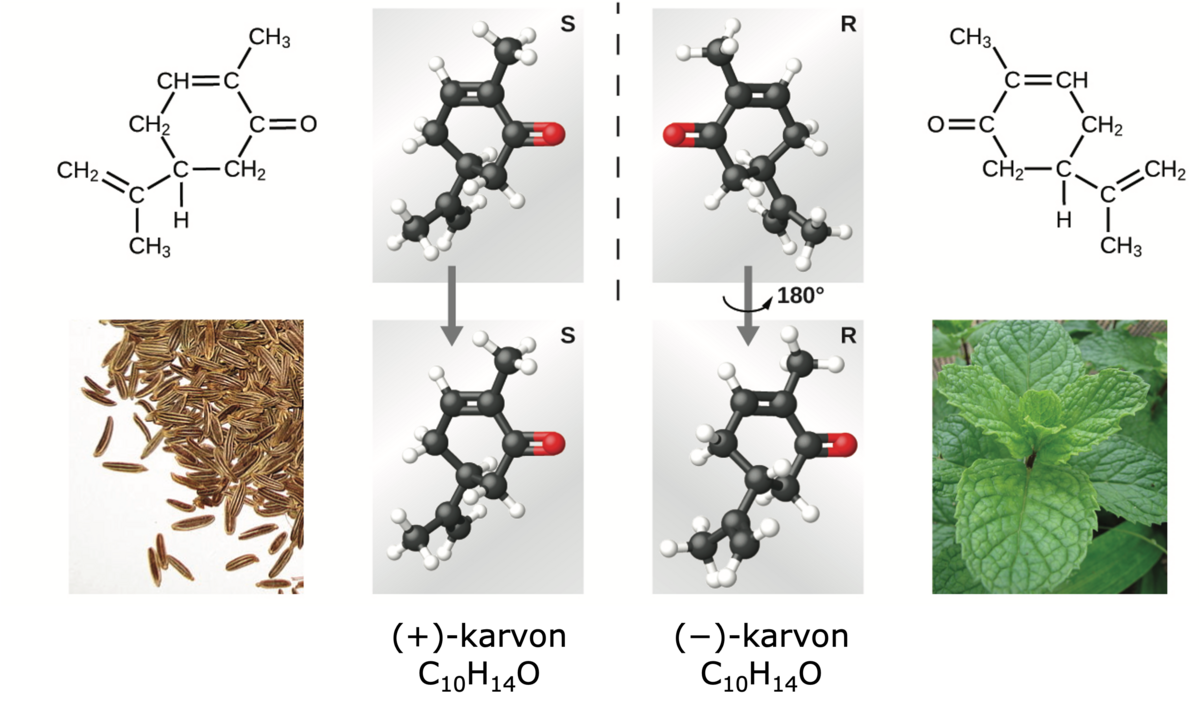
Isomerer kan være veldig ulike molekyler og bare tilfeldigvis ha den samme molekylformelen. Isomerer kan også være veldig like molekyler, slik som enantiomerer. Et eksempel er de to formene karvon kan ha. Den ene formen lukter karve, mens den andre lukter grønnmynte (spearmint). Enantiomerer er bygd opp på samme måte, men samtidig er de så ulike som venstre og høyre fot. En venstrefot passer bare til den ene skoen i et skopar. På samme måte vil de to formene av karvon oppfattes helt ulikt av menneskekroppen selv om de er bygd opp på akkurat samme måte, bare speilvendt av hverandre, slik som føtter og sko.
For å komme fra én isomer til en annen må man bryte kjemiske bindinger.
Isomerer omtales normalt i flertall (én isomer, flere isomerer) siden det er når man har nesten like molekyler at begrepet brukes. Hvis et molekyl ikke har noen isomerer, er ikke uttrykket aktuelt.
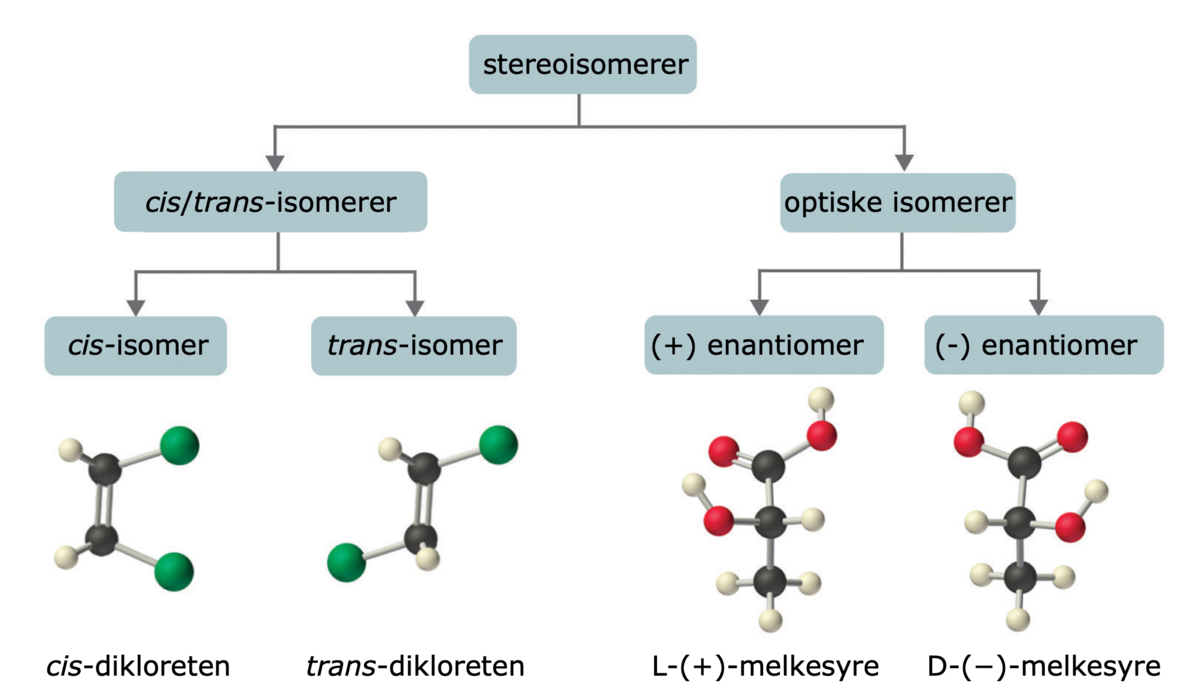
De vanligste formene for isomerer er: strukturisomerer, stereoisomerer og konformasjonsisomerer.







Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.